Категории
Сменить пароль!
Сброс пароля!


Во всем мире используется более 40 блокаторов Н1-гистаминовых рецепторов, но все ли они изучались в качественных контролируемых исследованиях с участием детей?
Представляем результаты рандомизированного, двойного слепого, плацебо-контролируемого исследования левоцетиризина у детей младшего возраста с атопическим дерматитом продолжительностью 18 месяцев.
Во всем мире используется более 40 блокаторов Н1-гистаминовых рецепторов, но все ли они изучались в качественных контролируемых исследованиях с участием детей?
Представляем результаты рандомизированного, двойного слепого, плацебо-контролируемого исследования левоцетиризина у детей младшего возраста с атопическим дерматитом продолжительностью 18 месяцев.

Много лекарственных препаратов, предполагаемых безопасными и эффективными у детей, фактически никогда не изучались в проспективных, рандомизированных, двойных слепых, плацебо-контролируемых исследованиях с участием детей (1). Такие исследования критически важны, поскольку изменения в процессе развития могут кардинально повлиять на всасывание, метаболизм, выведение и действие лекарственных средств (2).
Во всем мире используется более 40 блокаторов Н1-гистаминовых рецепторов. Они могут взывать нежелательные эффекты не только посредством Н1-рецепторов в центральной нервной системе и в других локализациях, но также посредством мускариновых, альфа-адренергических и серотониновых рецепторов, а также посредством ионных каналов в сердце (3, 4). Несмотря на широкое применение Н1-блокаторов, иногда в течение нескольких месяцев или лет, а также на их предполагаемую безопасность опубликовано на удивление мало данных по их долгосрочной безопасности у пациентов любого возраста, в том числе у детей (5, 6).
Мы предположили, что пиперазиновый Н1-антигистаминный препарат левоцетиризин обладает профилем безопасности, схожим с таковым у детей младшего возраста с атопическим дерматитом. Мы проверили эту гипотезу в рандомизированном, двойном слепом, плацебо-контролируемом исследовании в параллельных группах продолжительностью 18 месяцев. Другие исходы данного исследования, в том числе недостаточная эффективность лечения левоцетиризином для профилактики или замедления развития бронхиальной астмы (основная конечная точка) и эффективность левоцетиризина в предотвращении крапивницы (дополнительная конечная точка), а также эпидемиологические исследования в исследуемой популяции будут опубликованы отдельно.
Протокол Исследования раннего предотвращения бронхиальной астмы у детей с атопическим дерматитом (EPAAC) был одобрен Экспертным советом в каждом из участвующих центров в 10 европейских странах, Австралии и ЮАР. Дети были включены в исследование после получения информированного согласия их родителей или опекунов.
Дизайн исследования был рандомизированным, двойным слепым, плацебо-контролируемым, в параллельных группах. Детей включали в исследование, если их возраст составлял 12-24 месяца, у них был атопический дерматит, повышенные уровни специфического IgE на пыльцу трав или клеща домашней пыли, а также аллергия в семейном анамнезе. Назначение лечения было выполнено в соответствии с предварительно выбранными факторами рандомизации на исходном уровне: статус сенсибилизации к пыльце растений или клещу домашней пыли, сенсибилизация к яйцам, бронхиальная астма в анамнезе у матери и страна проживания.
Детей исключали из исследования, если у них была бронхиальная астма или любые другие системные заболевания; если их рост или масса тела были меньше 5-го процентиля; если у них были какие-либо тяжелые неврологические или психологические расстройства, требующие медикаментозного лечения; если известно, что у них имелась непереносимость левоцетиризина или любого другого пиперазинового антигистамина либо парабенов, используемых в качестве консервантов в жидких лекарственных формах блокаторов Н1-гистаминовых рецепторов; если в их анамнезе или анамнезе их братьев/сестер были приступы апноэ во сне; либо если у них была почечная недостаточность или любое метаболическое состояние, которое может повлиять на выведение левоцетиризина. Перед включение в исследование было отменено обычное лечение другими блокаторами Н1-антигистаминных рецепторов.
В течение 18-месячного периода 255 детей получали лечение левоцетиризином в форме капель 0,125 мг/кг два раза в сутки, и 255 детей получались похожие капли плацебо два раза в сутки. Родители или опекуны отмечали в дневнике пациента нежелательные явления, дни, в которые отмечались симптомы бронхиальной астмы или крапивницы, а также дни приема лекарственного препарата. Данная информация была проверена в внесена координатором исследования в электронную индивидуальную регистрационную карту во время регулярного мониторинга по телефону, восьми запланированных визитов и дополнительных медицинских визитов, проводившихся в случаях необходимости на протяжении 18-месячного периода лечения. Возникшие во время лечения нежелательные явления были описаны исследователями в соответствии с основным классом систем органов, с использованием предпочтительной терминологии, закодированной в соответствии с Медицинским словарем для нормативно-правовой деятельности (MEDRA).
На протяжении исследования независимый Экспертный совет организации проводил мониторинг безопасности, не имея доступа к информации о распределении в группы, во время регулярно запланированных собраний два раза в год и посредством переписки по электронной почте между собраниями. Проверенные данные включали: стандартные сообщения о серьезных нежелательных явлениями, частых нежелательных явлениях, расцененных исследователем как возможно связанные с исследуемым лекарственным препаратом, а также о явлениях, приводящих к окончательной отмене лекарственного препарата.
Серьезное нежелательное явление обозначало любое неожиданное медицинское проявление, которое в любое время представляло угрозу жизни или приводило к госпитализации, стойкой или существенной нетрудоспособности или смерти. Кроме того, любое важное медицинское явление, которое могло поставить под угрозу ребенка или требовало вмешательства для предотвращения одного из выше перечисленных исходов, регистрировали как серьезное нежелательное явление.
Нежелательное явление регистрировали по спонтанным сообщениям в дневниках пациентов, а также при расспросе лица, обеспечивающего уход за ребенком, во время каждого запланированного визита: «Замечали ли Вы что-нибудь необычное в здоровье Вашего ребенка со времени последнего визита?» – с записью полученного ответа. Передозировка была определена как однократный прием исследуемого препарата в дозе 0,5 мг/кг или больше.
Во время каждого визита возвращали ранее выданные флаконы из-под лекарственного препарата: пустые, частично использованные или неиспользованные, и в присутствии опекуна ребенка проводили сверку приема препарата. Затем прием исследуемого препарата оценивали путем измерения веса каждого возвращенного флакона и вычитания его значения из веса флакона во время выдачи препарата.
Психомоторное развитие оценивали путем опроса опекуна об основных этапах развития ребенка с использованием опросника во время регулярно запланированных визитов. Вопросы об общем моторном развития включали возраст, в котором ребенок научился самостоятельно сидеть, ползать, самостоятельно стоять, самостоятельно ходить, подниматься по лестнице с помощью, самостоятельно подниматься по лестнице и бегать. Вопросы о развитии мелкой моторики включали возраст, в котором ребенок впервые продемонстрировал умение сжимать пальцы (два пальца), держать карандаш (тремя пальцами), способность складывать кубики (строить башню из четырех кубиков) и предпочтительное использование правой или левой руки. Вопросы о развитии речи и языка включали возраст, в котором ребенок впервые произнес пять отдельных слов, назвал много предметов и стал говорить короткими предложениями. В подгруппе детей из Великобритании и Австралии также использовали Опросник коммуникативного развития МакАртура (MCDI – McArthur Communicative Development Inventory), Шкалу оценки родителем способностей ребенка (PARCA – Parent Report of Children’s Abilities) и Лист наблюдения за поведением ребенка; эти результаты будут представлены отдельно.
Исходно и после 18 месяцев лечения левоцетиризином и плацебо, на выбранный участок кожи наносили крем ЭМЛА и путем прямой венепункции отбирали образец крови (8 и 10 мл, соответственно). Лабораторные исследования для контроля безопасности включали: гемоглобин, гематокрит, число тромбоцитов, лейкоцитов и подсчет лейкоцитарной формулы; уровни аспартаттрансаминазы, аланинтрансаминазы, общего билирубина, общего белка, креатинина, и С-реактивного белка.
Если ребенок досрочно выбывал из исследования, все анализы, запланированные на визит в 18 месяцев, проводили во время выхода из исследования, т.е. на последнем визите в рамках исследования.
Статистический анализ
Переменные безопасности были перечислены в индивидуальном порядке для подробного клинического обзора. Лабораторные значения, рост и вес, а также изменения лабораторных показателей, роста и веса по сравнению с исходным уровнем были представлены с помощью описательной статистики по группам лечения, при этом 95% ДИ был рассчитан по медиане.
Нежелательные явления были кратко описаны по группе лечения, классу органов и предпочтительному термину, а также были охарактеризованы по степени тяжести, связи с исследуемым препаратом и выходу из исследования. Основные показатели развития были описаны по группе лечения. Все анализы безопасности были проведены на популяции с назначенным лечением, определенной как все рандомизированные дети, которые получили хотя бы одну дозу исследуемого лекарственного препарата.
Популяция всех рандомизированных пациентов включала 510 детей: 255 (средний возраст ± SD: 19,3 ± 0,3 месяца, 60,8% были мальчиками) в группе лечения левоцетиризином и 255 (средний возраст ± SD: 19,4 ± 0,2 месяца, 64,3% мальчиков) в группе лечения плацебо. 219 (85,9%) детей, которые получали левоцетиризин и 216 (84,3%) детей, которые получали плацебо, завершили 18-месячное лечение. В группе детей, получавших лечение левоцетиризином, общая суточная доза варьировала от 2,825 мг до 3,830 мг. Оценка соблюдения лечения, выраженная по точной оценке приема исследуемого препарата, была возможна приблизительно у 60% детей и составила на основании расчетов (± SD): 97,8% ± 27,6% у детей, получавших лечение левоцетиризином, и 97,0% ± 17,9% у детей, получавших плацебо.
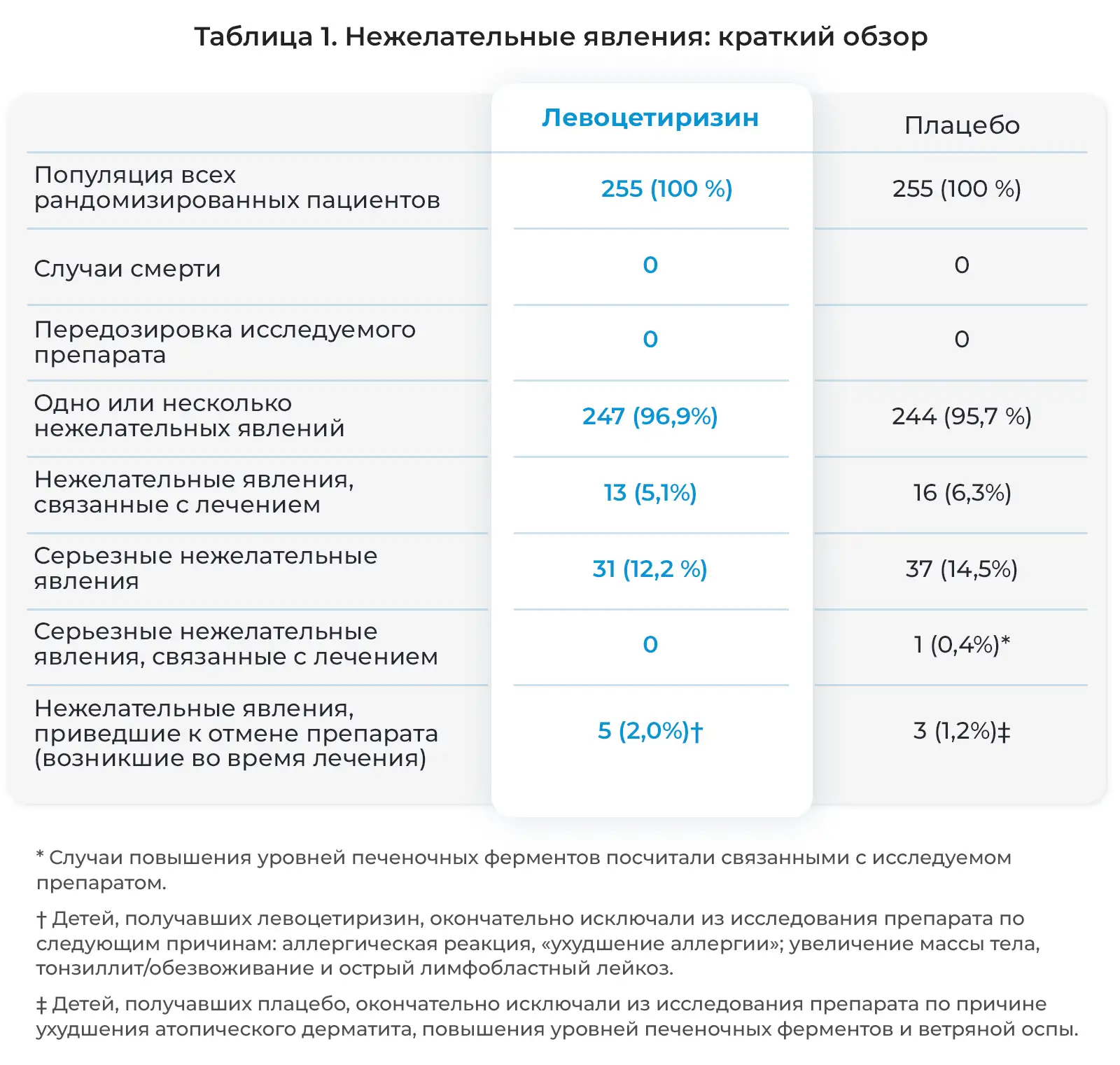
В целом, нежелательные явления возникали со схожей частотой в обеих группах лечения, как указано в Таблице 1. Не отмечалось случаев смерти и передозировки исследуемых препаратов.
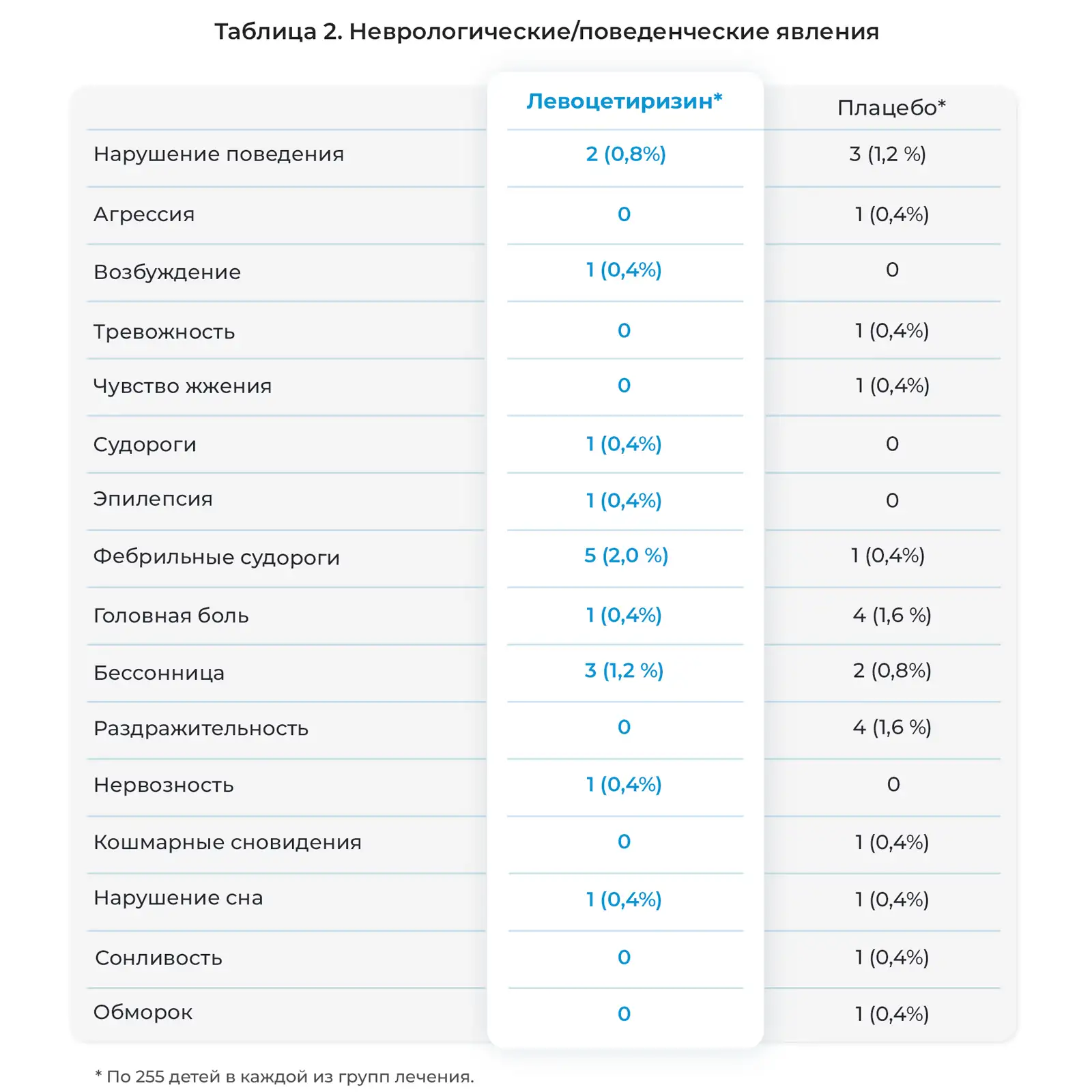
Как подробно описано в дневниках пациентов и электронных индивидуальных регистрационных картах, нежелательные явления возникли у большинства детей, участвовавших в исследовании на протяжении 18 месяцев и получавших активное лечение. Как правило, данные явления были легкими и возникали со схожей частотой в двух группах лечения (Рис. 1). Чаще всего отмечались следующие явления: инфекции верхних дыхательных путей (ИВДП), а также похожие или сопутствующие явления, дословно описанные исследователями как ринофарингит, ринит, фарингит, отит среднего уха, тонзиллит, вирусная инфекция, ринорея, ларингит, вирусная ИВДП и острый тонзиллит. Также часто отмечались пиретическая реакция (лихорадка), гастроэнтерит, рвота и диарея. Кроме того, часто отмечались кашель, бронхит, аллергический ринит, конъюнктивит, ухудшение атопитического дерматита и сезонные аллергии, а также ветряная оспа и прорезывание зубов. Нежелательные явления, связанные с центральной нервной системой, отмечались нечасто (Таблица 2). Фебрильные судороги часто отмечались у детей, получавших левоцетиризин, а проблемы с поведением и раздражительностью чаще отмечались у детей, получавших плацебо.
Серьезные нежелательные явления отмечались у 12,2% детей, получавших левоцетиризин, и 14,5% детей, получавших плацебо (Таблица 3). У 30-месячной девочки развилась лимфаденопатия, и был диагностирован острый лимфобластный лейкоз. Ребенок был выведен из исследования. Исследователь и Экспертный совет организации посчитали связь этого явления с исследуемым препаратом маловероятной. Код исследования был раскрыт в связи с серьезным характером заболевания, и было установлено, что ребенок принимал левоцетиризин в дозе 1,75 мг/сутки. У нее отмечен ответ на химиотерапию. У четырех детей отмечались фебрильные судороги, описанные как серьезные нежелательные явления. Ранее у них отмечались фебрильные заболевания: пиелонефрит, гастроэнтерит, отит среднего уха или ИВДП. У всех четырех детей связь судорог и исследуемым препаратом посчитали маловероятной, и все эти пациенты завершили исследование. При раскрытии кода препарата в конце исследования оказалось, что эти дети были в группе лечения левоцетиризином. У одного из этих детей, у брата которого в анамнезе была эпилепсия, впоследствии развились рецидивирующие судороги, и была диагностирована эпилепсия.
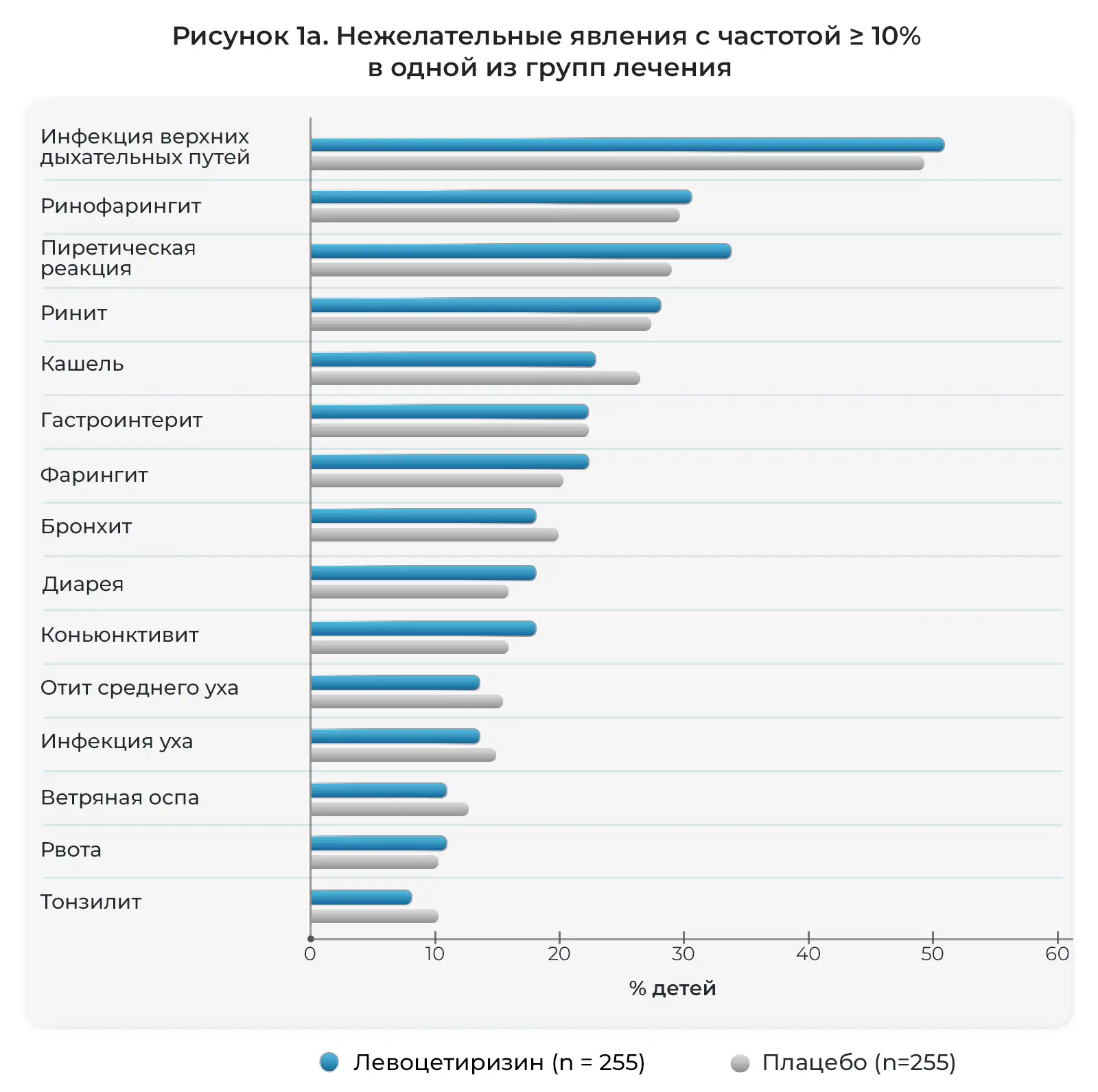
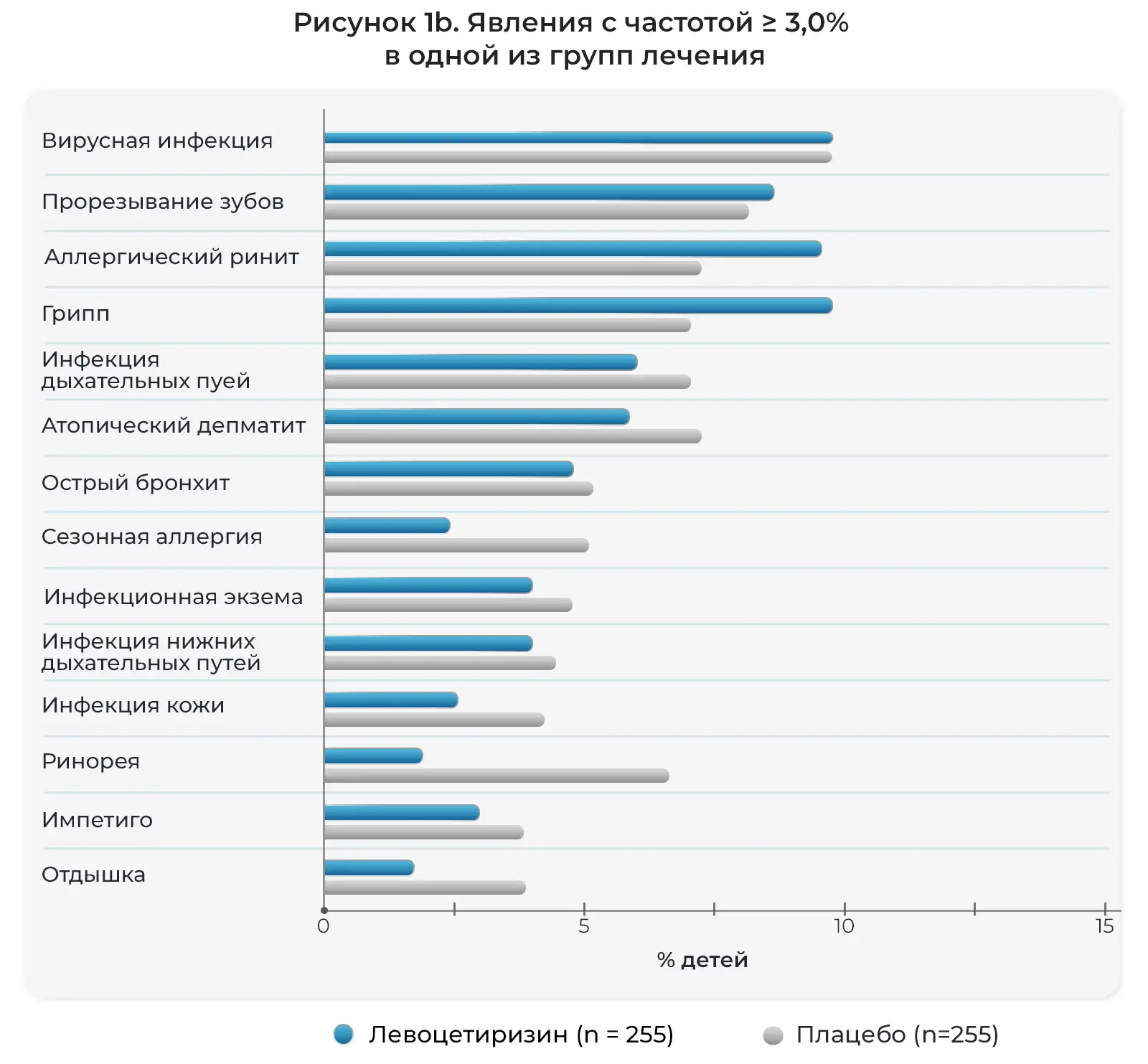
Соотношение детей с нежелательными явлениями, возникшими во время лечения, описанными исследователями (предпочтительные термины MEDRA).
Примечание: шкалы на горизонтальных осях на Рис. 1a,b различаются
Возникшие во время лечения нежелательные явления, описанные исследователем по основному классу систем органов с использованием предпочтительной терминологии, закодированные по Медицинскому словарю для нормативно-правовой деятельности.
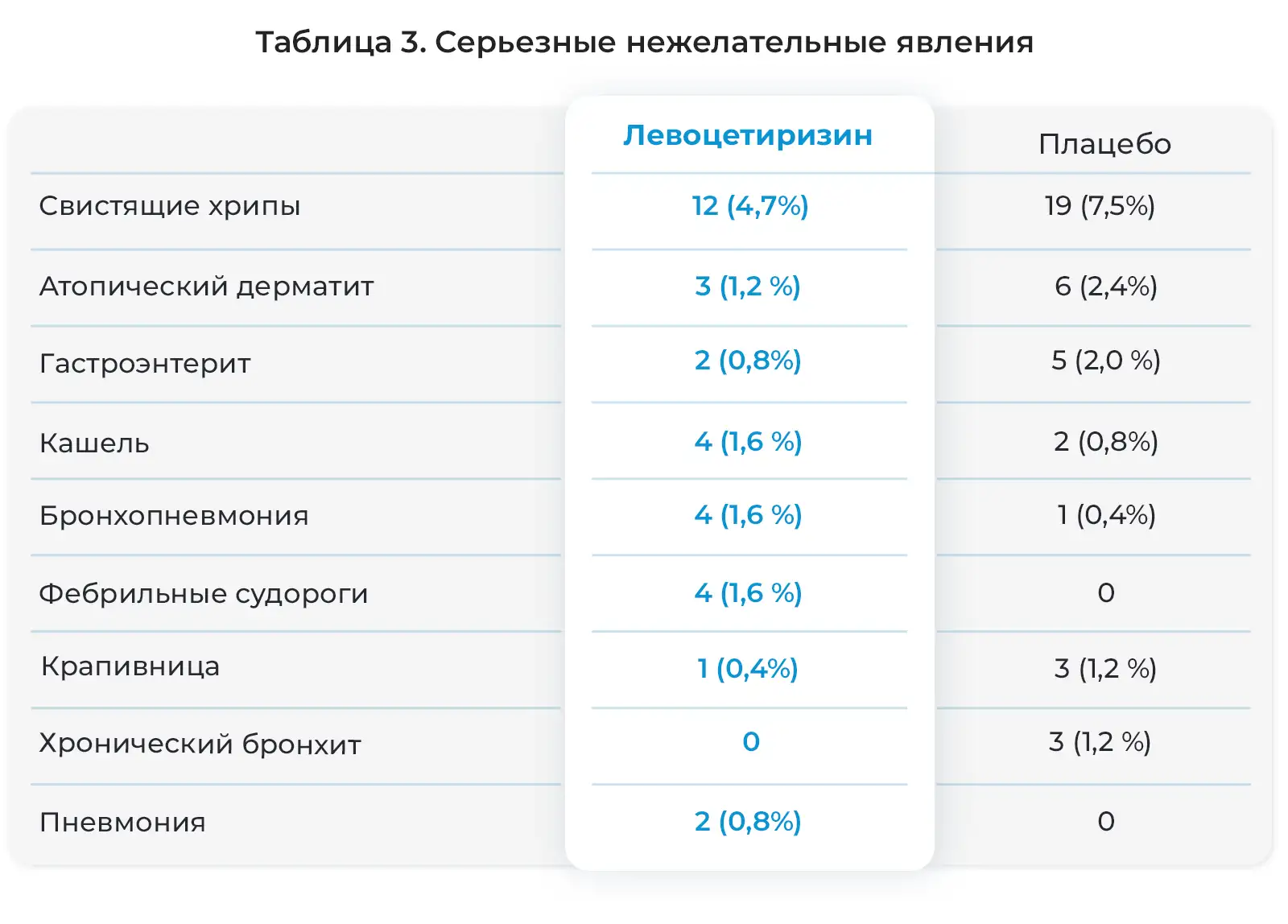
Кроме вышеуказанных серьезных нежелательных явлений, каждое из которых отмечалось более, чем у одного ребенка в одной из групп лечения, другие явления отмечались по одному только у одного ребенка (0,4%) из 255 детей, получавших левоцетиризин, как описано исследователями. Эти явления были следующими: острый тонзиллит, бронхит, острый бронхит, ангионевротический отек, сотрясение мозга, судороги, обезвоживание, одышка, пищевое отравление, травма головы, инфекция нижних дыхательных путей, лимфобластный лейкоз (острый), незаращение артериального протока, пиелонефрит, кожная инфекция, тонзиллит, инфекция верхних дыхательных путей (ИВДП), вирусная ИВДП, рвота и повышение массы тела.
Другие серьезные нежелательные явления, каждое из которых возникло только у одного ребенка (0,4%) из 255 детей, получавших плацебо, по сообщениям исследователей были следующими: ангионевротический отек, бронхиальная астма, запор, диарея, диспепсия, одышка, экзема (инфекционная), пищевая аллергия, гастроэнтерит (ротавирусный), инфекция, вызванная Haemophilus influenzae, повышение уровня печеночных ферментов, повышенная чувствительность, пиелонефрит (острый), полип прямой кишки, подкожный абсцесс и вирусная инфекция.
Исследователи оценили несколько нежелательных явлений в качестве связанных с лечением (Таблица 1). Окончательная отмена исследуемых препаратов по причине побочных действий отмечалась редко: у 2,0% детей, получавших левоцетиризин, и у 1,2% детей, получавших плацебо (Таблица 1); чаще она была связана с отзывом согласия (8,6% и 8,2%, соответственно), потерей связи с пациентом для последующего наблюдения (1,6% и 3,1%, соответственно) или с другими причинами, в том числе с отклонением от протокола (1,6% и 3,2%, соответственно).
Соответствующие возрасту физиологические изменения роста и массы тела отмечались на протяжении 18 месяцев исследования. В какой-либо из моментов времени не отмечалось достоверных различий в росте или массе тела между детьми, получавшими левоцетиризин и плацебо (Рис. 2).
Основные этапы развития крупных моторных навыков, мелких моторных навыков, а также речевых и языковых навыков были достигнуты в соответствующих возрастах (Таблице 4). Не отмечалось достоверных различий между детьми, получавшими левоцетиризин и плацебо, в отношении достижения каких-либо основных этапов развития.
Был получен и проанализирован 941 образец крови из ожидаемых 1020; 476 - у детей, получавших левоцетиризин, и 465 у детей, получавших плацебо. На протяжении 18 месяцев исследования с исходного уровня до конца лечения отмечались соответствующие возрасту физиологические изменения параметров общего и биохимического анализа крови. Средние изменения результатов лабораторных анализов к концу лечения по сравнению с исходным уровнем представлены в Таблице 5. Не отмечалось достоверных различий между детьми, получавшими левоцетиризин и плацебо.
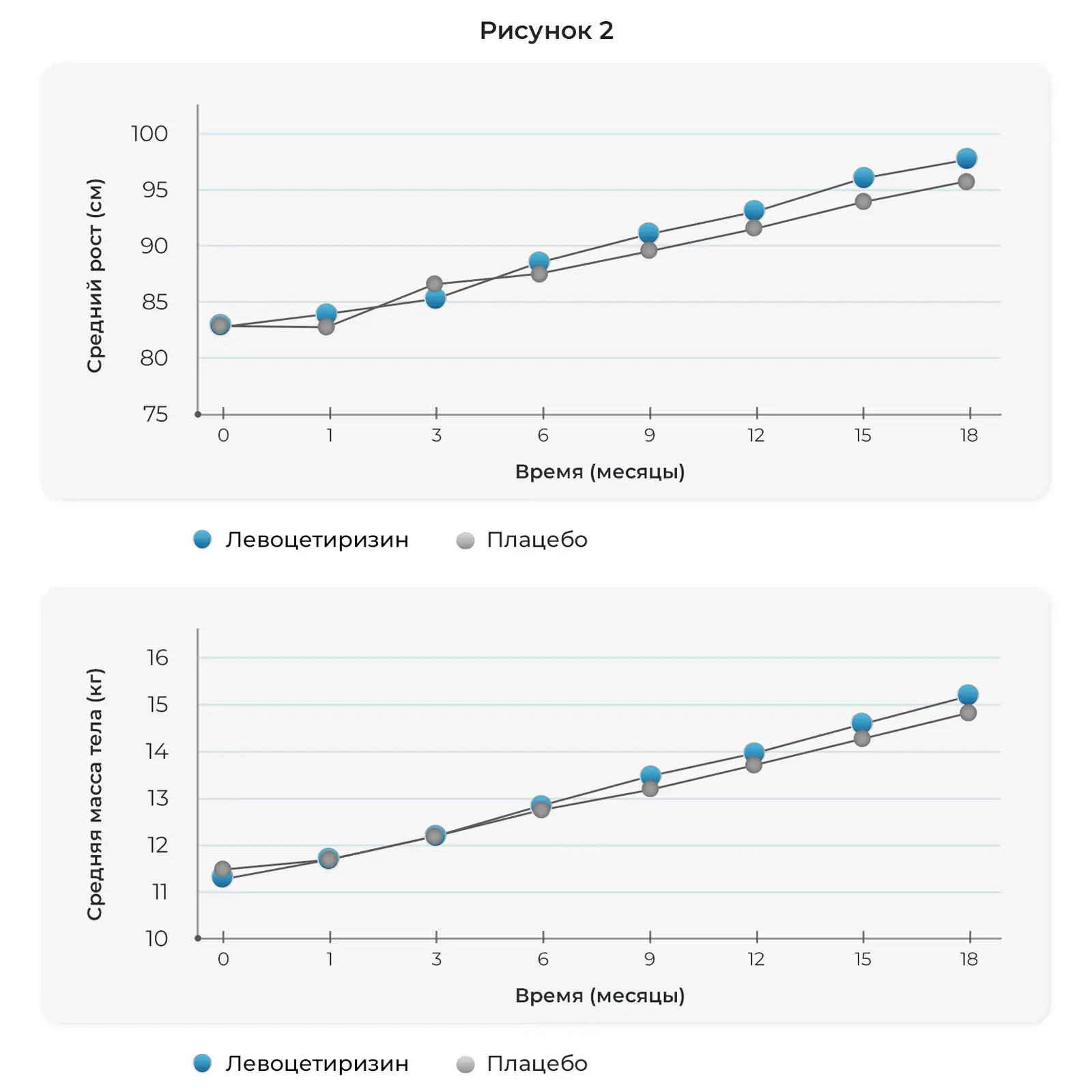
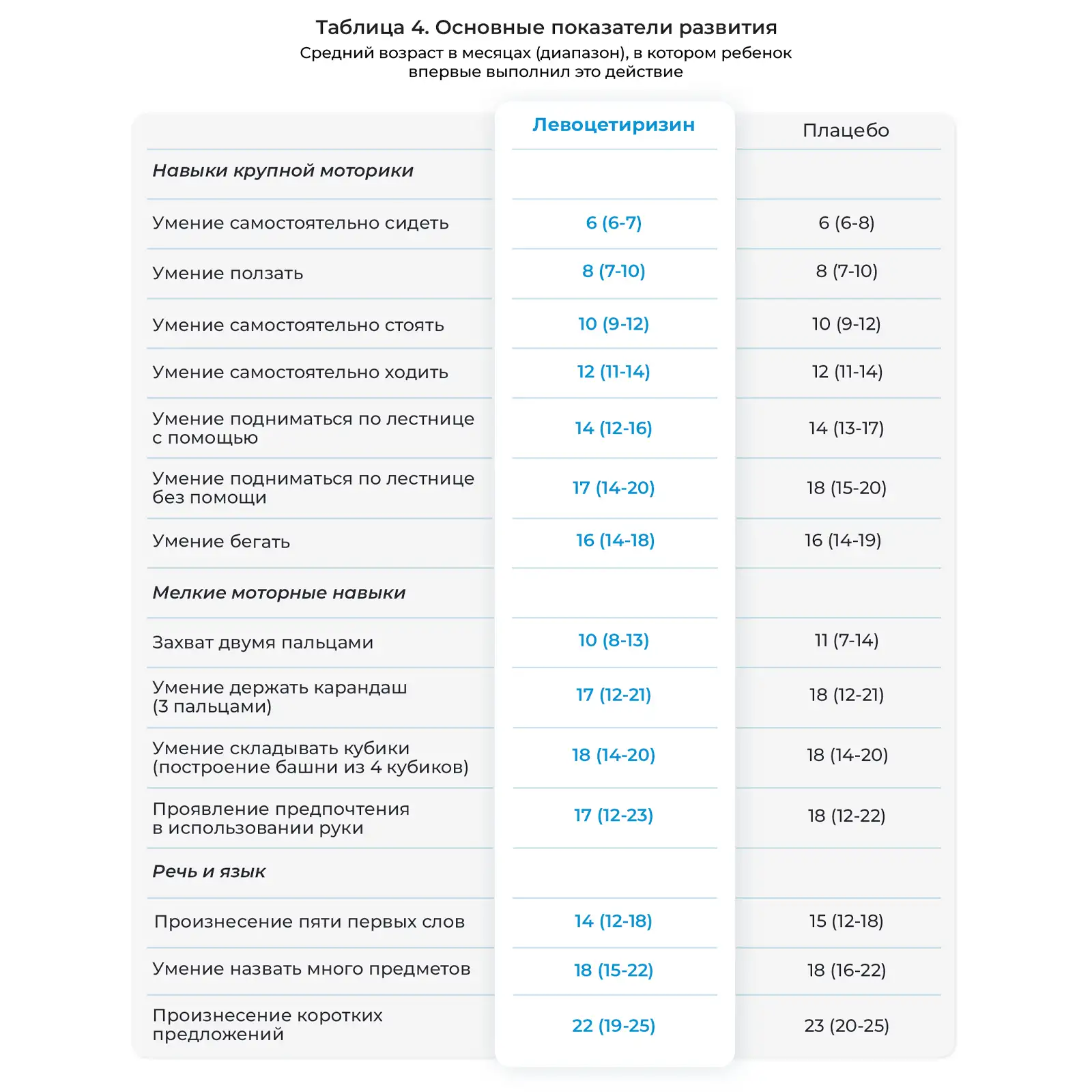
Данное исследование характеризовалось низкой частотой выбывания на протяжении 18 месяцев, соблюдением режима приема исследуемых препаратов, небольшим числом побочных действий, связываемых с исследуемым препаратом или приводящим к постоянной отмене препарата, а также относительно полным набором клинической оценки и проведением общего и биохимического анализов крови. Несмотря на высокие дозы левоцетиризина, принимавшиеся в расчете мг/кг массы тела два раза в сутки, его профиль безопасности был схож с таковым у плацебо в ходе двойного слепого лечения на протяжении 18 месяцев. Показали роста и массы тела увеличивались с возрастом, как и ожидалось, в обеих группах лечения. Не отмечалось побочного действия на развитие крупных моторных навыков, мелких моторных навыков, речевых и языковых навыков. Изменения в показателях общего и биохимического анализа крови были схожими в группах левоцетиризина и плацебо и отражали нормальное развитие и созревание функций органов.
Необходимо отдельно прокомментировать два серьезных нежелательных эффекта. Левоцетиризин не применяли у ребенка, у которого развился острый лимфобластный лейкоз и которого вывели из исследования по причине этого серьезного явления. Фактически, в клеточных линиях острого лимфобластного лейкоза ингибитор Н1-гистаминовых рецепторов дифенгидрамин ингибирует клональный рост и индуцирует апоптоз. Также было доказано, что лекарственные препараты данного класса оказывают благоприятное действие при лечении рефракторного острого лимфобластного лейкоза (7, 8). Исследователи посчитали связь фебрильных судорог с исследуемым препаратом маловероятной, и все дети с такими судорогами закончили исследование. Однако при раскрытии кода лечения было установлено, что они были в группе лечения левоцетиризином. Нельзя полностью исключить вероятность того, что левоцетиризин сыграл свою роль, и это представляет собой интерес, поскольку в предыдущем 18‑месячном исследовании с участием детей с атопическим дерматитом фебрильные судороги чаще отмечались у детей, которые получали плацебо, чем цетиризин в дозе 0,25 мг/кг два раза в сутки (5). У детей в последней группе была такая же экспозиция левоцетиризина, активного L-энантиомера рацемического цетиризина, как у детей в предыдущем исследовании. Этот вопрос требует дальнейшего исследования в большей популяции детей с атопическим дерматитом, получающих блокаторы Н1-гистаминовых рецепторов; например, с использованием системы контроля за безопасностью назначаемых препаратов или ретроспективного когортного дизайна. Оба этих подхода ранее использовали для исследования потенциальных нежелательных эффектов блокаторов Н1-гистаминовых рецепторов у лиц старшего возраста (9, 10).
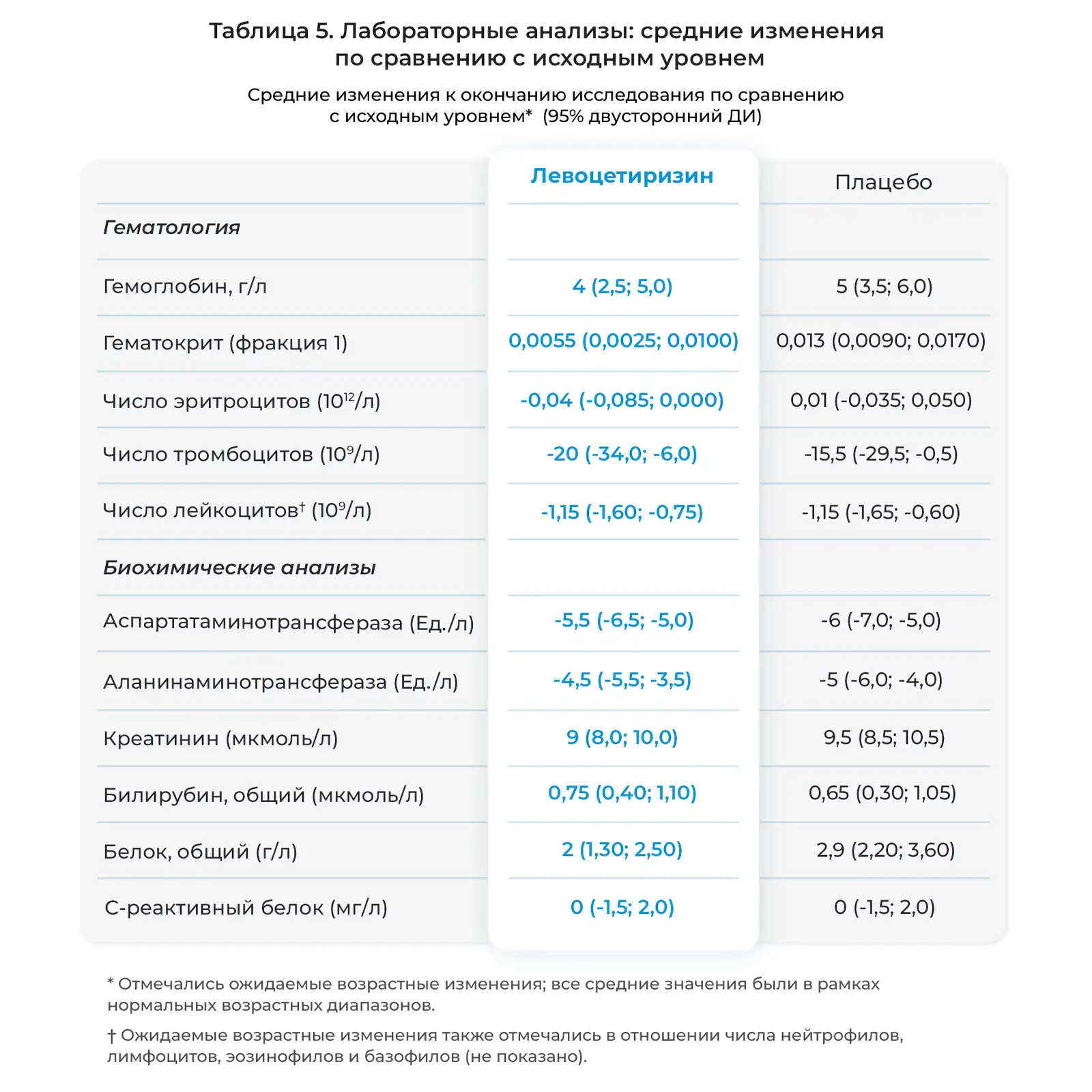
Левоцетиризин высоко селективен в отношении Н1-рецепторов человека, при этом он обладает подтвержденной стабильностью и сродством связывания, в два раза превышающим таковое у цетиризина. Он выводится, главным образом, в неизмененном виде с мочой путем клубочковой фильтрации. У детей младшего возраста отмечены высокие показатели клиренса левоцетиризина (11-13); соответственно, в данной популяции необходимо принимать левоцетиризин в высоких дозах в расчете мг/кг массы тела, два раза в сутки. Созревание почечной функции происходит на протяжении младенчества и раннего детства, и к возрасту 4-5 лет созревание выведения с почками заканчивается (2). У детей в возрасте 6-11 лет функция почек относительно зрелая, показатели клиренса левоцетиризина ниже, чем у детей младшего возраста, а занятость Н1-рецепторов выше (14, 15); соответственно, рекомендован режим приема один раз в сутки.
Лишь несколько из более чем 40 блокаторов Н1-гистаминных рецепторов, доступных во всем мире, изучали проспективным образом в течение одного или более лет регулярного ежедневного приема (3-6). Такие исследования критически важны, поскольку у людей часто отмечается несколько проявлений аллергического заболевания одновременно, и они могут применять блокаторы Н1-гистаминовых рецепторов периодически или регулярно на протяжении многих лет для облегчения зуда и других симптомов аллергии.
Блокаторы Н1-гистаминовых рецепторов - это обратные агонисты гистамина, натурального соединения с хорошо охарактеризованными эффектами при остром и хроническом аллергическом воспалительном ответе и с менее известной, но важной ролью в здоровье человека, осуществляемой посредством различных биологических эффектов во многих системах организма (3). Таким образом, более старые лекарственные средства, так называемые блокаторы Н1-гистаминовых рецепторов первого поколения, которые оказывают действие на мускариновые, альфа-адренергические и серотониновые рецепторы, помимо Н1-рецепторов могут оказывать различные нежелательные эффекты, даже при применении в рекомендованных дозах (3, 4, 16-22). Они проникают через гематоэнцефалический барьер, снижают передачу нервных импульсов в центральной нервой системе и обладают склонностью к угнетению центральной нервной системы путем седативного эффекта и ухудшения когнитивных и психомоторных функций. У новорожденных и детей младшего возраста они могут вызывать парадоксальную стимуляцию центральной нервной системы. Более старые блокаторы Н1-гистаминовых рецепторов также могут оказывать побочное действие посредством мускариновых рецепторов, приводя к сухости во рту, задержке мочи и синусовой тахикардии, а также посредством альфа-адренергических рецепторов, приводя к артериальной гипотензии и рефлекторной тахикардии. Кроме того, некоторые блокаторы Н1-гистаминовых рецепторов первого поколения, такие как ципрогептадин и кетотифен могут повышать аппетит посредством антигистаминных и(или) антисеротониновых эффектов. Даже при местном нанесении на кожу блокаторы Н1-гистаминовых рецепторов, такие как дифенгидрамин или прометазин, могут приводить к системной токсичности (3, 4).
Блокаторы Н1-гистаминовых рецепторов первого поколения связывали с синдромом внезапной детской смерти, хотя причинно-следственная связь так и не была доказана (3, 4). После передозировки они могут вызывать расширение зрачка, приливы крови к лицу, тахикардию, угнетение дыхания, артериальную гипотензию, судороги, кому и смерть (3, 4, 16-22). Их используют в качестве седативных средств (3, 4, 23, 24), несмотря на непостоянную эффективность (25), а также в качестве стимуляторов аппетита (26) и «социальных препаратов» для контроля детского поведения (27). С ужасом приходится отметить, что их также использовали для убийства новорожденных и детей младшего возраста (3, 4, 17-19).
Так называемые блокаторы Н1-гистаминовых рецепторов второго поколения существенно безопаснее своих предшественников (3-6, 28-31), несмотря на то, что на настоящий момент имеется лишь несколько проспективных исследований этих лекарственных средств с участием детей (28) и несколько долгосрочных исследований их безопасности у детей младшего возраста (5, 6). Не отмечалось случаев смерти после передозировки (30, 31). Блокаторы Н1-гистаминовых рецепторов второго поколения, астемизол и терфенадин, обладают склонностью блокировать IKr и другие ионные каналы сердца, потенциально вызывая удлинение интервала QT и желудочковую аритмию. В результате, в большинстве стран их регистрация была аннулирована (3, 4).
Здесь описано одно из наиболее продолжительных проспективных, рандомизированных, двойных слепых, плацебо-контролируемых исследований безопасности какого-либо из блокаторов H1-гистаминовых рецепторов, которые когда-либо проводили в любой возрастной группе. Оно подтверждает безопасность блокатора H1-гистаминовых рецепторов левоцетиризина у детей младшего возраста с атопическим дерматитом. В схожей популяции детей младшего возраста безопасность цетиризина была хорошо задокументирована в 18-месячном рандомизированном, двойном слепом, плацебо-контролируемом исследовании (5, 29, 30), а безопасность лоратадина была документально подтверждена в 12-месячном исследовании (6). Блокаторы Н1-гистаминовых рецепторов часто используют для лечения симптомов аллергического ринита и крапивницы, и поскольку эти расстройства могут возникать периодически или сохраняться на протяжении многих лет, критически важны долгосрочные исследования безопасности приема и других лекарственных препаратов этого класса у пациентов детского возраста.
Благодарности
Выражаю благодарность команде UCB EPAAC, особенно, д-ру Marie-Etienne Pinelli, Catherine Fortpied и Marah Wajskop за их помощь.
_____________
Список литературы
1. Steinbrook R. Testing medications in children. N Engl J Med 2002: 347: 1462-70.
2. Kearns GL, Abdel-Rahman SM, Alander SW, Blowey DL, Leeder JS, Kauffman RE. Developmental pharmacology - drug disposition, action, and therapy in infants and children. N Engl J Med 2003: 349: 1157-67.
3. Simons FER. Advances in H1-antihistamines. N Engl J Med 2004: 351: 2203-17.
4. Simons FER. H1-antihistamines in children. In: Simons FER, ed. Histamine and H1-Antihistamines in Allergic Disease, 2nd edn. New York, N.Y.: Marcel Dekker, Inc., 2002: 437-64.
5. Simons FER, on behalf of the ETAC Study Group. Prospective, long-term safety evaluation of the H1-receptor antagonist cetirizine in very young children with atopic dermatitis. J Allergy Clin Immunol 1999: 104: 433-40.
6. Grimfeld A, HoLgATE ST, Canonica GW, et al. Prophylactic management of children at risk for recurrent upper respiratory infections: the Preventia I Study. Clin Exp Allergy 2004: 34: 1665-72.
7. JANgi S-M, Asumendi A, Arlucea J, et al. Apoptosis of human T-cell acute lymphoblastic leukemia cells by diphenhydramine, an H1 histamine receptor antagonist. Oncol Res 2004: 14: 363-72.
8. Malaviya R, Uckun FM. Histamine as an autocrine regulator of leukemic cell proliferation. Leuk Lymphoma 2000: 36: 367-73.
9. Mann RD, Pearce GL, Dunn N, Shakir S. Sedation with ‘non-sedating’ antihistamines: four prescriptionevent monitoring studies in general practice. Br Med J 2000: 320: 1184-7.
10. Finkle WD, Adams JL, Greenland S, Melmon KL. Increased risk of serious injury following an initial prescription for diphenhydramine. Ann Allergy Asthma Immunol 2002: 89: 244-50.
11. Simons FER, on behalf of the ETAC study group Population pharmacokinetics of levocetirizine in very young children: the pediatricians’ perspective. Pediatr Allergy Immunol 2005: 16: 97-103.
12. Hussein Z, Pitsiu M, Majid O, et al. Retrospective population pharmacokinetics of levocetirizine in atopic children receiving cetirizine: the ETAC study. Br J Clin Pharmacol 2005: 59: 28-37.
13. Cranswick N, Turzikova J, Fuchs M, Hulhoven R. Levocetirizine in 1-2 year old children: pharmacokinetic and pharmacodynamic profile. Int J Clin Pharmacol Ther 2005: 43: 172-7.
14. Simons FER, Simons KJ. Levocetirizine: pharmacokinetics and pharmacodynamics in children age 6 to 11 years. J Allergy Clin Immunol 2005: 116: 355-61.
15. Simons KJ, Benedetti MS, Simons FER, Gillard M, Baltes E. Relevance of H1-receptor occupancy to H1-antihistamine dosing in children. J Allergy Clin Immunol 2007: 119.
16. Wyngaarden JB, Seevers MH. The toxic effects of antihistaminic drugs. JAMA 1951: 145: 277-82.
17. Baker AM, Johnson DG, Levisky JA, et al. Fatal diphenhydramine intoxication in infants. J Forensic Sci 2003: 48: 425-8.
18. Jumbelic MI, Hanzlick R, Cohle S. Alkylamine antihistamine toxicity and review of pediatric toxicology registry of the National Association of Medical Examiners. Am J Forensic Med Pathol 1997: 18: 65-9.
19. Nine JS, Rund CR. Fatality from diphenhydramine monointoxication: a case report and review of the infant, pediatric, and adult literature. Am J Forensic Med Pathol 2006: 27: 36-41.
20. Scharman EJ, Erdman AR, Wax PM, et al. Diphenhydramine and dimenhydrinate poisoning: an evidence-based consensus guideline for out-of-hospital management. Clin Toxicol (Phila) 2006: 44: 205-23.
21. Yamashita Y, Isagai T, Seki Y, Ohya T, Nagamitsu S, Matsuishi T. West syndrome associated with administration of a histamine H1 antagonist, oxato- mide. Kurume Med J 2004: 51: 273-5.
22. Starke PR, Weaver J, Chowdhury BA. Boxed warning added to promethazine labeling for pediatric use. N Engl J Med 2005: 352: 2653.
23. Owens JA, Rosen CL, Mindell JA. Medication use in the treatment of pediatric insomnia: results of a survey of community-based pediatricians. Pediatrics 2003: 111: e628-35.
24. Leelataweedwud P, Vann Jr WF. Adverse events and outcomes of conscious sedation for pediatric patients: study of an oral sedation regimen. J Am Dent Assoc 2001: 132: 1531-9.
25. Merenstein D, Diener-West M, Halbower AC, Krist A, Rubin HR. The trial of infant response to diphenhydramine: the TIRED study - a randomized, controlled, patient-oriented trial. Arch Pediatr Adolesc Med 2006: 160: 707-12.
26. Daviss WB, Scott J. A chart review of cyproheptadine for stimulant-induced weight loss. J Child Adolesc Psychopharmacol 2004: 14: 65-73.
27. Allotey P, Reidpath DD, Elisha D. ‘Social medication’ and the control of children: a qualitative study of over-the-counter medication among Australian children. Pediatrics 2004: 114: e378-83.
28. Simons FER, Silas P, Portnoy JM, Catuogno J, Chapman D, Olufade AO. Safety of cetirizine in infants 6 to 11 months of age: a randomized, doubleblind, placebo-controlled trial. J Allergy Clin Immunol 2003: 111: 1244-8.
29. Stevenson J, Cornah D, Evrard P, et al. Long-term evaluation of the impact of the H1-receptor antagonist cetirizine on the behavioral, cognitive and psychomotor development of very young children with atopic dermatitis. Pediatr Res 2002: 52: 251-7.
30. Ridout SM, TARiq SM. Cetirizine overdose in a young child. J Allergy Clin Immunol 1997: 99: 860-1.
31. Cobb DB, Watson WA, Fernandez MC. High-dose loratadine exposure in a six-year-old child. Vet Hum Toxicol 2001: 43: 163-4.
Приложение
Команда исследования EPAAC
Члены совета исследования EPAAC: J. O. Warner (Саутгемптон, Великобритания); C.K. Naspitz (Сан-Паулу, Бразилия); F.E.R. Simons (Виннипег, Канада); T.L. Diepgen (Гейдельберг, Германия); U. Wahn (Берлин, Германия); F.M. de Benedictis (Анкона, Италия).
Представители команды UCB EPAAC (Брюссель, Бельгия): M. Wajskop, M. de Longueville; C. Fortpied; M-E Pinelli, F. Staelens.
Исследователи и соисследователи
Д-ра W. Emminger, B. Kafer, D. Stefanovic, V. Plank (Вена, Австрия); K. Desager, M. Hagendorens (Антверпен, Бельгия); J. Levy (Марсель, Франция); H. Kiekens (Ремшайд, Германия); J. Sokalska, E. Masnica-Wasylkowska, I. Biegun-Awramineko, M. Chlon (Гливице, Польша); H.C. Weber, R.P. Edson (Гудвуд, ЮАР); L. Dymek, A. Dymek, A. Bozek (Стшельце-Опольске, Польша); P. Van Asperen, A. Kakakios, W. Nichtingale, K. McKay (Вестмид [Сидней], Австралия); P. Sly, R. Loh, A. Halbert, T. Douglas, S. Stick (Субиако [Перт], Австралия); D. Hill, R. Heine, D. Bannister (Парквиль [Северный Мельбурн], Австралия); M. Gold, P. Quinn, H. Marshall. M. Kummerow (Северная Аделаида, Австралия); M. Zach, A. Pfleger, E-M Varga (Грац, Австрия); L. De Raeve, A. Malfoort (Брюссель, Бельгия); A. De Moor (Алст, Бельгия); J. Chladkova, T. Chyba (Градец-Кралове, Чехия); H. Honomichlova, P. Honomichlova-Houdkova, P. Honomichl (Пльзень-Лохотин, Чехия); F. Kopriva (Оломоуц, Чехия); V. Petru, A. Carbolova, K. Kopecka (Прага 5, Чехия); P. Pohunek, T. Svobodova (Прага 5, Чехия); O. Rybnicek (Брно, Чехия); O. Skopkova, V. Balcarek (Острава 9, Чехия); V. Spicak, K. Kopecka, M. Maltulka (Прага 8, Чехия); M. Spicakova, S. Kynclova (Прага 4, Чехия); F. Payot (Лион, Франция); E. Billard, M. Robert (Шамбери, Франция); F. Cambazard, J-L Perrot, L. Fond (Сент-Этьен 2, Франция); H. Cartier (Аррас, Франция); M-C Castelain (Лилль, Франция); M. Petrus (Тарб, Франция); F. Rance, G. Le Manach (Тулуза 3, Франция); J. Robert (Вольс-ан-Велен, Франция); M. Ruer (Мартиг, Франция); D. Abeck, J. Ring, I. Forer, M. Vogel, S. Fischer (Мюнхен, Германия); D. Bulle (Хюккесваген, Германия); R. Dolderer (Штутгарт, Германия); F. Friedrichs, C. Pfannenstiel (Аахен-Лауренсберг, Германия); S. Jobst, H. Schatz (Байройт, Германия); B. Niggemann, C. Gruber (Берлин, Германия); U. Schauer (Бохум, Германия); E. Rietschel, L. Lange, S. Mueller, S. Van Koningsbruggen (Кёльн, Германия); I. Tichmann-Schumann, R. Wornle (Мюнхен, Германия); A. von Berg, B. Albrecht, C. Bollrath (Везель, Германия); T. Zimmermann, M. Hertl, T. Froehlich-Krapf (Эрланген, Германия); H-G Bresser, K. Landwehr (Билефельд, Германия); L. Armemo, M.C. Massagli, L. Brunetti, P. Fiermonte, M. Rana, L. Granieri, M. Lore (Бари, Италия); G. Barberio, V. Tiralongo, D. Vita, R. Feliciotto, L. Caminiti (Мессина, Италия); A. Boner, E. Fasoli, I. Romei, L. Alfonsi (Верона, Италия); A. Capristo, C. Capristo, N. Maiello, F. Decimo, A. Rocco, M. Miraglia del Giudice (Неаполь, Италия); G. Cavagni, A. Spattini, S. Pas- torelli, A. Messori (Сассуоло, Италия); M. Duse, V. Porteri, C. Belotti (Брешиа, Италия); A. Fiocchi, T. Sarratud, L. Terr- acciano, A. De Chiara (Милан, Италия); F. Franceschini, L. Pietroni, B. Bruschi (Анкона, Италия); E. Galli, P. Giampietro, G. Mancino, E. Arabito (Рим, Италия); G. Marseglia, G. Lombardini, A. Ricci, S. Caimmi, A. Napoli, C. Tzialla, V. Ghiglione (Павия, Италия); M. Masi, A. Patriza, F. Specchia, B. Bigucci, G. Ricci, A. Miniachi (Болонья, Италия); P. Rossi, M. Chianca, V. Moschese, L. Chini (Рим, Италия); J. Alkiewicz, A. Breborowicz (Познань, Польша); A. Swiatly, A. Szczawinska-Popkonyl, M. Kulesza-Kazecka (Рим, Италия); A. Boznanski, E. Willak-Janc, A. Latkowska (Вроцлав, Польша); D. Chlebna-Sokol, A. Stanczyk, J. Wlazlowski, I. Ligenza (Лодзь, Польша); D. Chmielewska-Szewczyk, J. Lange, J. Peradzynska, M. Kulus (Варшава, Польша); A. Emeryk, H. Milanowska, G. Zywicka, M. Bartkowiak- Emeryk, E. Chojna (Люблин, Польша); M. Kaczmarski, B. Cudowska, J. Wasilewska, E. Matuszfwska (Белосток, Польша); B. Kamer, K. Pyziak, R. Pasowska, J. Zwaigzne- Racynska (Лодзь, Польша); R. Kurzawa, A. Wojcik, U. Jedrys-Klucjasz, E. Urbanek-Jozwik (Рабка-Здруй, Польша); T. Latos, E. Pomaranska, G. Gaszczyk, B. Makuch, J. Stanisz, J. Bokiej (Карпач, Польша); G. Lis, E. Cichocka-Jarosz, I. Glodzik, T. Szczerbinski (Краков, Польша); T. Malaczynska, B. Klajna-Kraluk (Гданьск, Польша); E. Najberg, E. Nowicka, A. Chrupek (Варшава, Польша); E. Sikorska, M.T. Jarlinska (Вроцлав, Польша); A. Nieto Garcia, L. Caballero, R. Pamies, F. Oliver, M. Evole, A. Mazon (Валенсия, Испания); M. Bosque Garcia, L. Valdesoiro, O. Asensio, H. Larramona (Сабадель, Испания); J.L. Eseverri Asin, E. Munoz (Барселона, Испания); M.T. Giner, A.M. Plaza, M. Piquer Gilbert, E.P. Diaz Gonzalez, M.A. Martin, J. I. Sierra (Эсплугес-де-Льобрегат, Испания); J.L. Corzo, E. Rojas, R. Santos (Малага, Испания); C. Bruynzeel-Komen, S. Pasmans, Y. Meijer, A.E. Flinterman (Утрехт, Нидерланды); E.J. Duiverman, M. Brouwer, A. Niewenhuis, B. Rottier, S. van der Heide (Гронинген, Нидерланды); A.P. Oranje, P. Kemperman, T. Breedjik, F. De Waard-van der Spek (Роттердам, Нидерланды); J.G.M. Rijntjes, H. Sillevis Smitt, J.C. Van Nierop (Амстердам, Нидерланды); H. Arshad, Dr B. Pereira, G. Roberts (Ньюпорт, остров Уайт, Великобритания); R. Clifford (Дорчестер, графство Дорсет, Великобритания); K. Foote, M.T. Sollis (Винчестер, Великобритания); J. O.B. Hourihane, G. Roberts (Саутгемптон, Великобритания); I. Pollock (Энфилд, Великобритания); A. Postma, L.F.G. Minders (Дурбан, Квазулу-Натал, ЮАР); A.S. Puterman, A.J. Morris (Клэрмонт, Кейптаун, ЮАР); J.H. Vermeulen (Паро, Кейптаун, ЮАР); P.J. White (Сомерсет-Уэст, ЮАР); Z.F.A. Vawda (Сиденхем, Квазулу-Натал, ЮАР); P. Potter, S. Emmanuel, A.F. Marian, D. Hawarden, C. Motala (Моубрей, Кейптаун, ЮАР); A. Morison, N. Clarke (Винберг, ЮАР); H.C. Weber, R.P. Edson (Беллвилл, Западный мыс, ЮАР); O.F. Jooma, M. Suleman (Питермарицбург, Квазулу-Натал, ЮАР); S. Mahomedy (Уэствилл, ЮАР); S.J. Reyneke, W. Havemann (Уэст Ханидью, ЮАР).
F. Estelle R. Simons от лица команды Исследования раннего предотвращения бронхиальной астмы у детей с атопическим дерматитом (EPAAC)* Кафедра педиатрии, детского здоровья и иммунологии, Канадские институты медицинских исследований, Национальная программа обучения по аллергии и бронхиальной астме; Медицинский факультет, Манитобский университет, Виннипег, Манитоба, Канада
Комментарии (0)