Категории
Сменить пароль!
Сброс пароля!


Авторы провели комплексную оценку безопасности шести клинических исследований I–III фазы для изучения безопасности будесонида в форме суспензии для приема внутрь (СБВ) у пациентов с эозинофильным эзофагитом (ЭоЭ).
У пациентов с эозинофильным эзофагитом установлена хорошая переносимость будесонида в форме суспензии для приема внутрь (топический кортикостероид для проглатывания) в различных дозировках.
Авторы провели комплексную оценку безопасности шести клинических исследований I–III фазы для изучения безопасности будесонида в форме суспензии для приема внутрь (СБВ) у пациентов с эозинофильным эзофагитом (ЭоЭ).
Были объединены данные по безопасности 6 исследований:
Была проведена оценка нежелательных явлений (НЯ), результатов лабораторных анализов, минеральной плотности костной ткани и НЯ со стороны надпочечников. Для оценки нежелательных явлений использовали частоту развития с поправкой на воздействие.
Учитывали данные 514 участников (СБВ 2,0 мг два раза в сутки, n = 292; СБВ в любой дозе, n = 448; плацебо, n = 168), что составило 93,7 пациенто-лет (ПЛ) воздействия в случае СБВ 2 мг, 122,4 — в случае СБВ в любой дозе и 25,0 — в случае плацебо. Сообщалось о более высокой частоте нежелательных явлений, возникших во время лечения (НЯВЛ), и нежелательных явлений, представляющих особый интерес, при применении СБВ по сравнению с плацебо; но они были легкой/средней степени тяжести.
В таблице 1 представлено описание наиболее часто регистрируемых нежелательных явлений, представляющих особый интерес (частота развития с поправкой на воздействие (на 100 человеко-лет)) в трех группах:
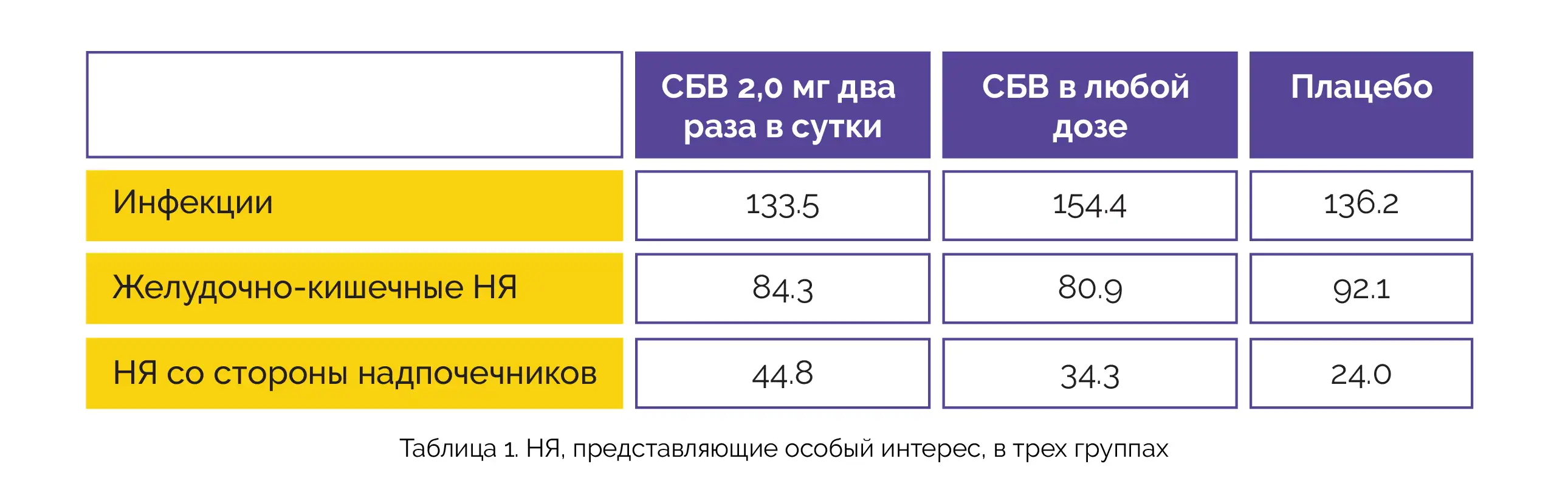
НЯ со стороны надпочечников чаще встречались при применении СБВ в дозе 2 мг два раза в сутки и СБВ в любой дозе по сравнению с плацебо. НЯ, возникшие во время лечения, и НЯ, представляющие особый интерес, связанные с исследуемой терапией или приведшие к отмене, были редки.
Установлено, что СБВ (исследуемая лекарственная форма будесонида) хорошо переносится; при этом большинство возникающих во время лечении НЯ при приеме СБВ были легкой/умеренной степени тяжести.
Alimentary Pharmacology and Therapeutics
Safety of an investigational formulation of budesonide (budesonide oral suspension) for eosinophilic oesophagitis: an integrated safety analysis of six phase 1–3 clinical trials
Ikuo Hirano и соавт.
Комментарии (0)