Категории
Сменить пароль!
Сброс пароля!


Несостоятельность пищеводно-дигестивного анастомоза является одним из самых опасных осложнений хирургических вмешательств при заболеваниях пищевода и желудка. В лечении этого состояния внутрипросветная вакуум терапия позволяет произвести адекватное дренирование зоны несостоятельности с обеспечением редукции гнойной полости.
Несостоятельность пищеводно-дигестивного анастомоза является одним из самых опасных осложнений хирургических вмешательств при заболеваниях пищевода и желудка. В лечении этого состояния внутрипросветная вакуум терапия позволяет произвести адекватное дренирование зоны несостоятельности с обеспечением редукции гнойной полости.
Несостоятельность пищеводно-дигестивного анастомоза (ПДА) является частым осложнением хирургического лечения заболеваний пищевода и желудка, и возникает в 3-6% случаев [10]. Доля летальных исходов этого осложнения остается стабильно высокой и достигает 60-80% [9,10]. Несостоятельность ПДА приводит к бактериальной контаминации средостения и брюшной полости. Для предупреждения этого, часто требуется повторная операция, в том числе и с выполнением экстирпации пищевода. Экстирпация пищевода, в свою очередь, приводит к глубокой инвалидизации пациента, так как чаще всего заканчивается формированием эзофагостомы и гастростомы или еюностомы.
Эти обстоятельства обусловили интерес хирургов к применению миниинвазивных методов лечения несостоятельности ПДА [1]. С этой позиции использование внутрипросветной вакуум терапии (ВВТ) позволяет произвести адекватное дренирование зоны несостоятельности с обеспечением редукции гнойной полости и предотвращением формирования гнойных затеков [1]. Первоначально метод широко применялся для лечения перфораций и ранений пищевода [3]. Однако в последние годы появилось достаточно исследований, позволяющих говорить о возможности использования ВВТ при лечении несостоятельности ПДА [1,4,5]. Механизм действия ВВТ связан с воздействием на ключевые моменты течения гнойных осложнений. Постоянное воздействие зоны пониженного давления на гнойный очаг приводит к нескольким эффектам:
В литературе описано два способа установки дренажной системы; первый — внутрипросветный, когда система находится в просвете пищевода в зоне неостоятельности, второй — внутриполостной, при котором аспиратор устанавливается непосредственно в гнойную полость через дефект в анастомозе ПДА [1].
Первый вариант предпочтителен при небольших (до 5-7 мм.) дефектах, и более прост технически. Второй вариант обеспечивает лучшее дренирование, но может применяться только при дефектах, размер которых, приблизительно равен или больше чем диаметр пищевода. Кроме того, второй вариант требует более высокой квалификации врача-эндоскописта.
Абсолютными противопоказаниями для применения ВВТ являются: сообщение полости абсцесса с внешней средой и визуализация в полости абсцесса крупных сосудов [6].
Относительные противопоказания для применения ВВТ: нестабильные показатели гемодинамики, размер дефекта ПДА более 3 см, несостоятельность сроком более 4-6 недель, невозможность визуализировать дефект ПДА при выполнении эзофагоскопии [6].
Согласно данным литературы, при применении ВВТ, снижение уровня маркёров острого воспаления достигается, в среднем, на 10 сутки. Среднее количество эндоскопических вмешательств для смены дренажной конструкции составляет 9 раз. Самым частым осложнением ВВТ являлось кровотечение из грануляций, во время смены дренажной системы и дислокация поролона при отрыве его от зонда [13]. Ни одно из этих осложнений не потребовало повторной операции, коррекция во всех случаях производилась эндоскопически.
В обзоре итальянских хирургов от 2018 года, приведены данные лечения 209 пациентов из разных европейских клиник [12]. Приблизительно у 80% больных, применение ВВТ привело к заживлению дефекта ПДА и выздоровлению. При этом у 9% пациентов, в отдалённом послеоперационном периоде возникли стриктуры анастомозов.
В условиях ГБУЗ ООД, для лечения несостоятельности ПДА внутрипросветная вакуум терапия впервые была применена в 2020 году у двух пациентов.
Материал и методы
Процедура выполняется под общим обезболиванием под контролем аппарата фиброгастродуоденоскопии (ФГДС). К области несостоятельности подводится назогастральный зонд диаметром 12-16 Fr, на активном конце которого фиксирована циркулярная манжетка, вырезанная из губчатого материала GranuFoam. Этот материал (поролон) используется в аспирационных дренажных системах типа endo-SPONGE. Обязательным условием конструкции является то, что все технологические отверстия зонда находятся внутри манжеты из губки для адекватного распределения давления по поверхности аспиратора (рис. 1 и рис 2). Манжета фиксируется к зонду нитью из нерассасывающегося материала, обычно полипропилена.

Рис. 1. Используемые в конструкции вакуум системы зонд и губка

Рис. 2. Готовая система для вакуум терапии
Первым этапом лечения является диагностическая эзофогоскопия, в ходе, которой, визуализируется дефект ПДА, оценивается его форма, размер, связь с другими структурами. Это позволяет окончательно определиться с тактикой лечения, и (при выборе парахирургического метода) со способом дренирования.
При выборе ВВТ, как метода лечения, выполняется изготовление дренажной конструкции. Сначала назогастральный зонд проводится через нос пациента и его конец выводится через рот. Затем, на конце зонда, фиксируется манжета из поролона (рис. 3, рис. 4).
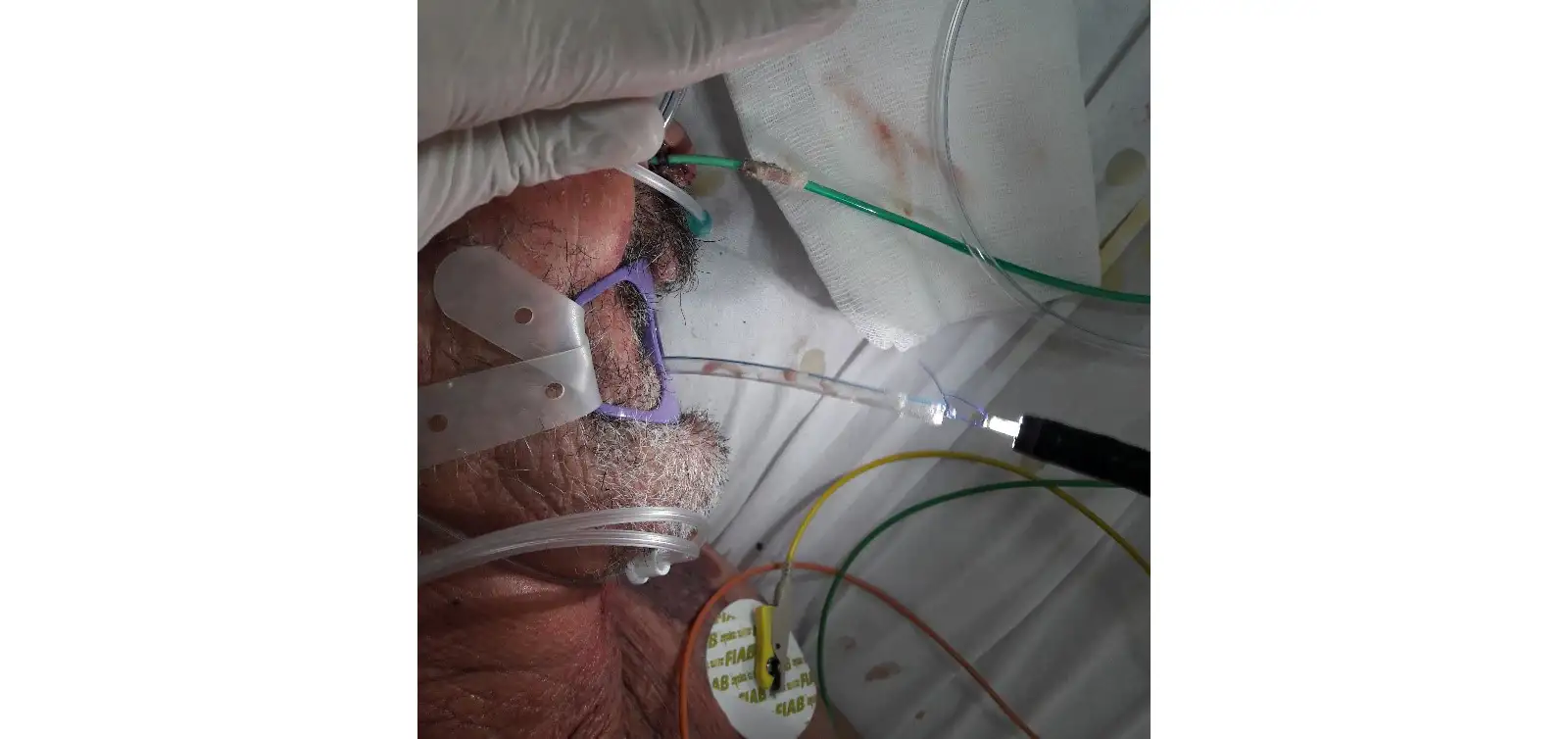
Рис. 3. Этап установки системы ВВТ. Выведение конца зонда через рот
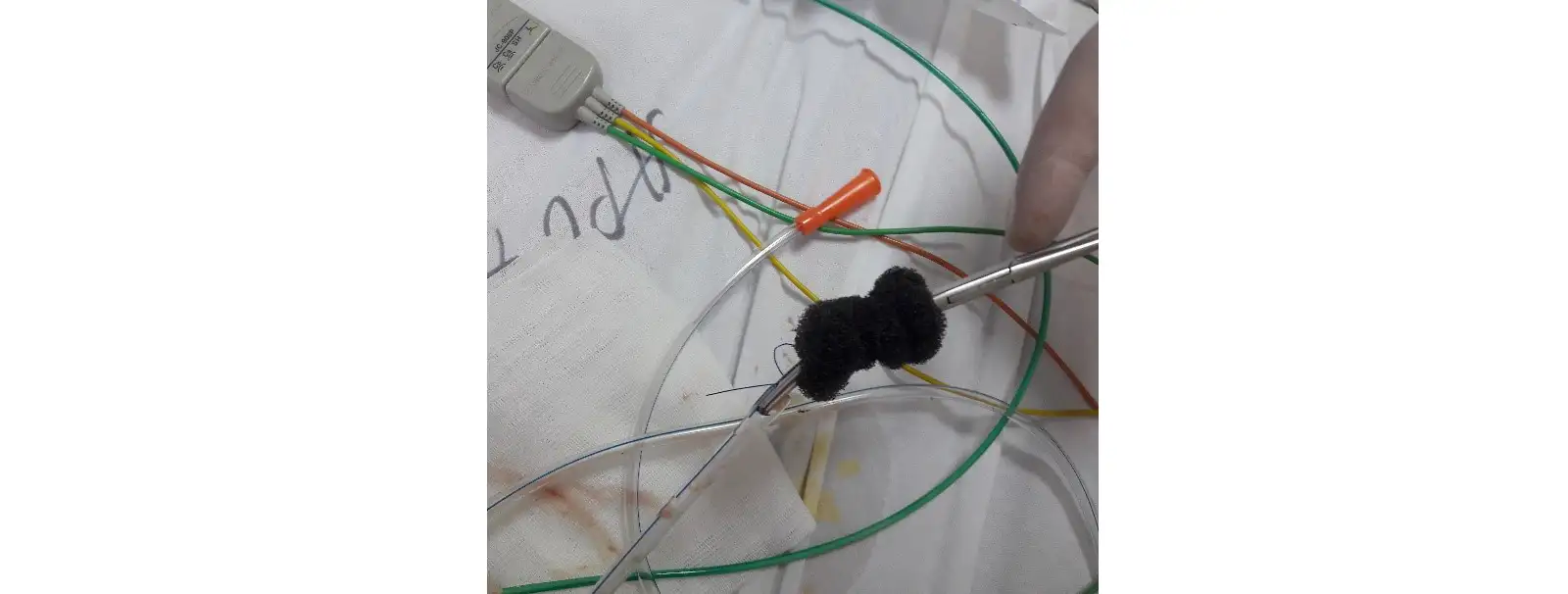
Рис. 4. Этап изготовления дренажной конструкции
Диаметр губчатой манжетки должен приблизительно соответствовать диаметру пищевода. При меньшем размере поролона не будет обеспечиваться формирование зоны пониженного давления. При большем размере возможна дополнительная травма области несостоятельности ПДА.
Следующим этапом производится заведение через нос тонкого зонда для энтерального питания. Зонд для кормления проводится под контролем аппарата ФГДС максимально дистальнее дефекта в ПДА.
После этого, готовая дренажная конструкция проводится под контролем аппарата ФГДС через рот пациента в пищевод (рис. 5)
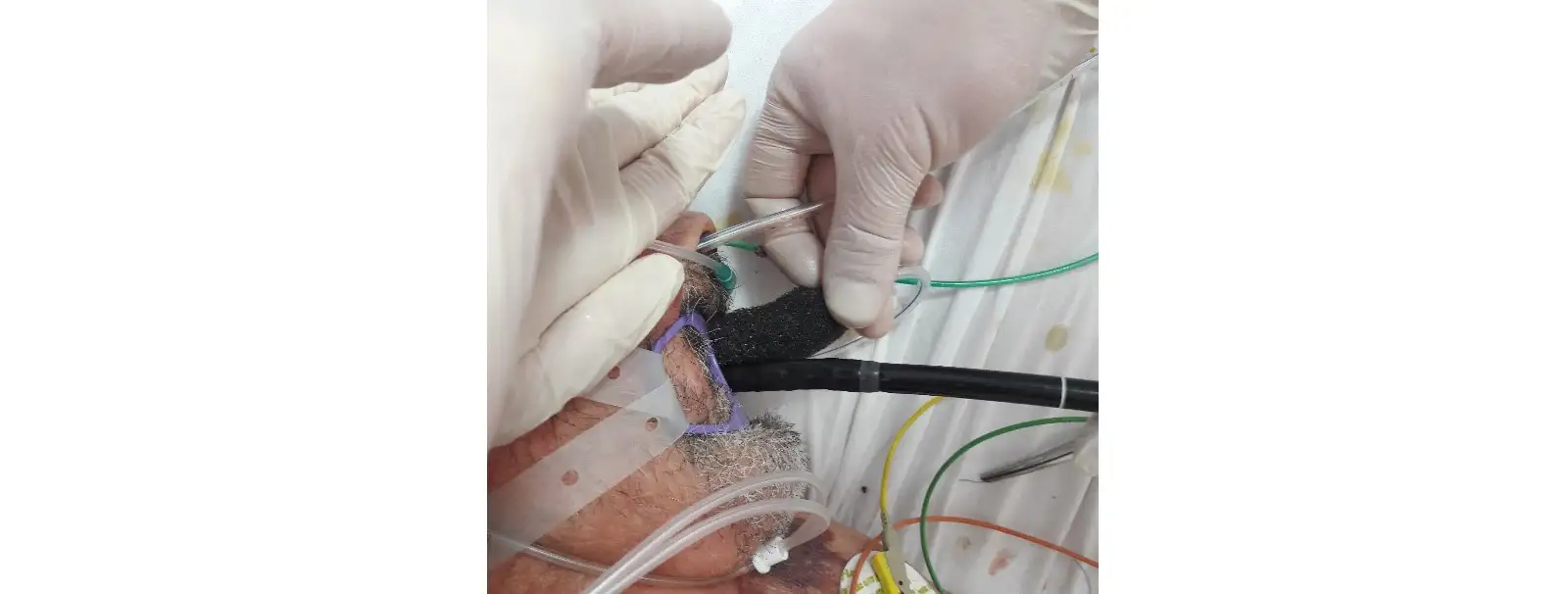
Рис. 5. Заведение дренажной конструкции
Аспирационная система подводится к месту несостоятельности ПДА под контролем аппарата ФГДС. Устанавливается постоянное разряжение в дренажной конструкции на уровне минус 125-175 мм.рт.ст. Смена конструкции осуществляется каждые 72-96 часов по описанной схеме. При этом каждый раз визуально оценивается динамика эндоскопической картины. Рентгеновская компьютерная томография (РКТ) выполнялась каждые 6-7 суток для оценки динамики воспалительного процесса и исключения формирования новых жидкостных скоплений в области ПДА.
Пациент Б. 60 лет, поступил в отделение абдоминальной хирургии 27 июля 2020 г. с диагнозом: Рак кардиального отдела желудка Т3N2М0G2 3А стадия. Согласно плану лечения 30 июля 2020 г. выполнена операция: видеотораколапароскопическая проксимальная резекция желудка, резекция пищевода с одномоментной эзофагогастропластикой в правой плевральной полости. Лимфодиссекция D-2.
В послеоперационном периоде на 7-ые сутки заподозрена несостоятельность ПДА. Выполнена РКТ с пероральным контрастированием. Выявлен дефект анастомоза, размером до 3 см, сообщающийся с правой плевральной полостью (рис. 6).
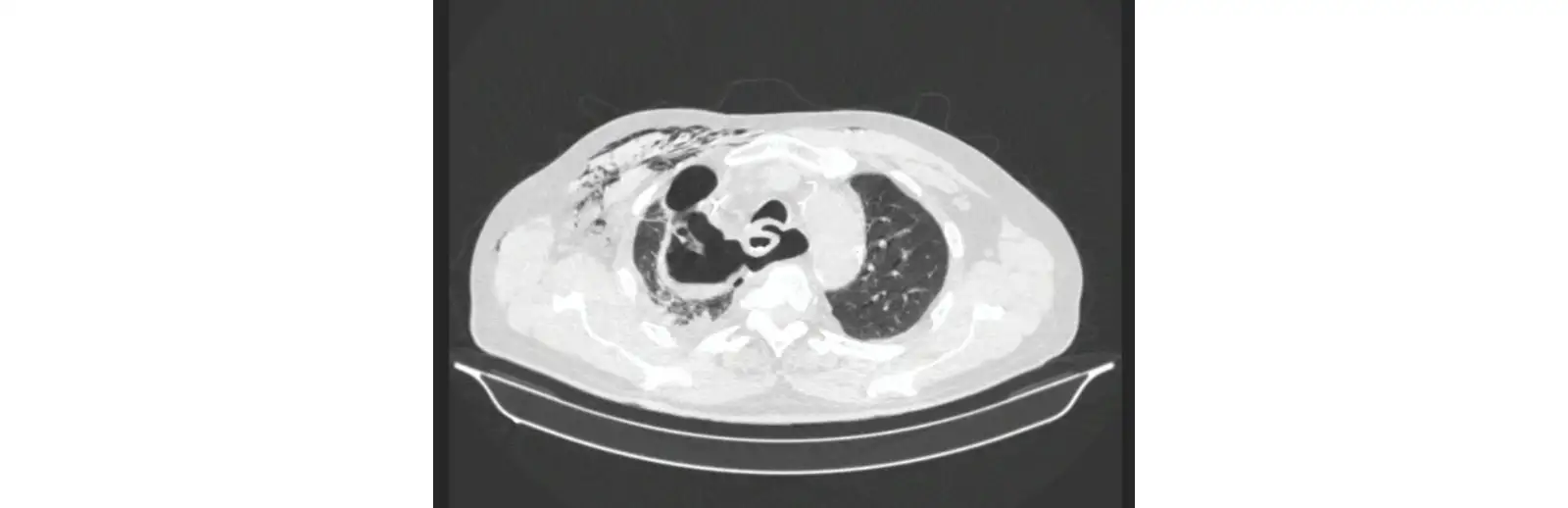
Рис. 6. Рентгеновская КТ пациента Б
При фиброэзофагоскопии обнаружен дефект степлерного эзофагоэнтероанастомоза, по боковой стенке, размером около 3 см. Установлена система для ВВТ. Смену конструкции осуществляли раз в 3 дня, питание проводилось через назоинтестинальный зонд. Снижение клинических маркеров воспаления — C-реактивного белка и лейкоцитоза до 50% от максимально фиксированного значения произошло на 3-и сутки от начала ВВТ. Эти показатели достигли нормальных значений на 22 сутки от начала лечения. На 15-е сутки от начала ВВТ, дефект анастомоза перестал определяться на РКТ (рис. 7).
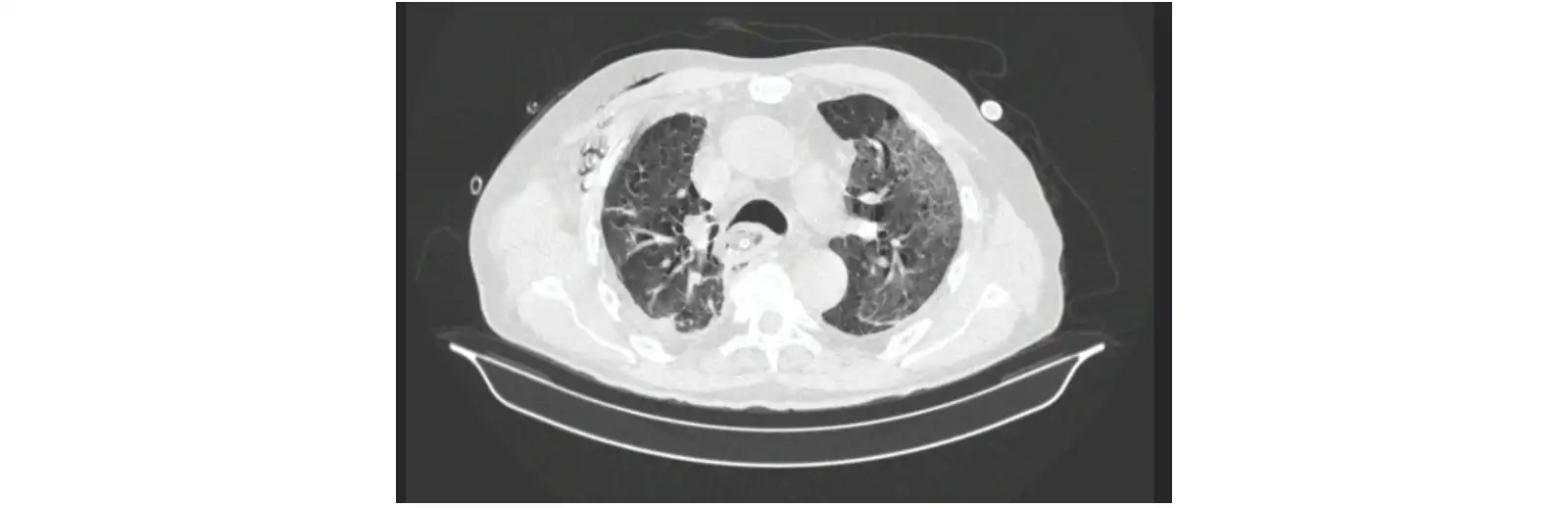
Рис. 7. Динамика рентгенологической картины пациента Б. через 2 недели после вакуум терапии
Через 3 недели проведения ВВТ, на эзофагоскопии не обнаружена несостоятельность ПДА. После этого пациенту разрешено пероральное питание, через 7 суток больной выписан из отделения.
Пациентка Ш. 63 лет. Поступила в отделение с рецидивом липосаркомы забрюшинного пространства с ростом опухоли в желудок. Ранее хирургическое лечение выполнялось 7 лет назад. 3 августа 2020 г. операция: комбинированное удаление неорганной забрюшинной опухоли с проксимальная резекция желудка, левосторонняя гемипанкреатэктомия. В послеоперационном периоде, на 4-е сутки, у пациентки появились признаки системной воспалительной реакции. На 10-е сутки диагностирована несостоятельность эзофагогастроанастомоза. На фиброэзофагоскопии выявлен округлый дефект ПДА, диаметром около 3 мм. Установлена система для ВВТ. Снижение клинических маркеров воспаления — C-реактивного белка и лейкоцитоза до 50% от максимально фиксированного значения произошло на 20 сутки, эти показатели достигли нормальных значений на 26 сутки от начала ВВТ. При эндоскопическом исследовании дефект ПДА перестал определяться на 15-е сутки проведения ВВТ. Больная выписана с выздоровлением на 26-е сутки послеоперационного периода.
Приведенный анализ литературных источников и клинические наблюдения позволяют судить об эффективности и относительной безопасности метода ВВТ при лечении несостоятельности ПДА.
Методика ВВТ требует наличие в клинике достаточной инструментальной базы.
АВТОРЫ
Загайнов Александр Сергеевич – врач онколог, хирург онкологического отделения хирургических методов лечения (абдоминальная хирургия) ГБУЗ ООД Адрес: 664035 г. Иркутск ул Фрунзе, 32 e-mail: allexw@yandex.ru ORCID: http://orcid.org/ 0000-0003-1363-6051
Загайнова Елена Андреевна – врач онколог, уролог онкологического отделения хирургических методов лечения (онкоурология) ГБУЗ ООД г. Иркутск. Адрес: 664035 г. Иркутск, ул. Фрунзе, 32. e-mail: zagainova.irk@yandex.ru ORCID: https://orcid.org/0000-0002-4757-2642
Зубков Роман Александрович – кандидат медицинских наук, главный врач ГБУЗ ООД г. Иркутск. Адрес: 664035 г. Иркутск, ул. Фрунзе, 32. e-mail: rzub@yandex.ru
Портяной Дмитрий Михайлович – врач онколог, эндоскопист отделения эндоскопии ГБУЗ ООД г. Иркутск. Адрес: 664035 г. Иркутск, ул. Фрунзе, 32
_______________
Литература:
1. Leeds S.G., Burdick J.S,, Fleshman W.J. Endoluminal Vacuum Therapy for Esophageal and Upper Intestinal Anastomotic Leaks. JAMA Surg. 2016; 151(6): 573-574.
2. Arezzo A., Miegge A., Garbarini A., Morino M. Endoluminal vacuum therapy for anastomotic leaks after rectal surgery. Tech Coloproctol 2010; 14: 279.
3. Argenta L.C., Morykwas M.J. Vacuum-assisted closure: a new method for wound control and treatment: clinical experience. Ann Plast Surg 1997; 38: 563.
4. Ahrens M., Schulte T, Egberts J, Schafmayer C., Hampe J., Fritscher-Ravens A., Broering D. C., Schniewind B. Drainage of esophageal leakage using endoscopic vacuum therapy: a prospective pilot study. Endoscopy 2010; 42:693.
5. Ward M.A., Hassan T., Burdick J.S., Leeds S.G. Endoscopic vacuum assisted wound closure (EVAC) device to treat esophageal and gastric leaks: assessing time to proficiency and cost. Surg Endosc 2019; 33:3970.
6. Pines G., Bar I., Elami A., Bar I., Elami A., Sapojnikov S., Hikri O., Ton D., Mosenkis B., Melzer E. Modified Endoscopic Vacuum Therapy for Nonhealing Esophageal Anastomotic Leak: Technique Description and Review of Literature. J Laparoendosc Adv Surg Tech A 2018; 28:33.
9. Turkyilmaz A., Eroglu A, Aydin Y., Tekinbas C., Muharrem Erol M., Karaoglanoglu N. The management of esophagogastric anastomotic leak after esophagectomy for esophageal carcinoma / // Diseases of the Esophagus. – 2009. – № 22. – P. 119–126.
10. Inokuchi M., Otsuki S., Fujimori Y., Sato Y., Nakagawa M., Kojima K. Systematic review of anastomotic complications of esophagojejunostomy after laparoscopic total gastrectomy. World J Gastroenterol 2015; 21(32): 9656–65.
11. Wedemeyer J., Schneider A., Manns M.P., Jackobs S. Endoscopic vacuum-assisted closure of upper intestinal anastomotic leaks. Gastrointest Endosc 2008; 67: 708.
12. Virgilio E., Ceci D., Cavallini M. Surgical Endoscopic Vacuum-assisted Closure Therapy (EVAC) in Treating Anastomotic Leakages After Major Resective Surgery of Esophageal and Gastric Cancer. Anticancer Res 2018; 38: 5581.
13. De Moura D.T., de Moura B.F., Manfredi M.A., Hathorn K.E., Bazarbashi A. N., Ribeiro I.B., de Moura E.G., Thompson C.C. Role of endoscopic vacuum therapy in the management of gastrointestinal transmural defects. World J Gastrointest Endosc 2019. 11: 329–344.
врач онколог Загайнов А.С., врач онколог Загайнова Е.А., к.м.н. Зубков Р.А., врач онколог Портяной Д.М.
Комментарии (0)